-
Blogs

DV rút tiền thẻ tín dụng Quận 7 uy tín bảo mật
Rút tiền từ thẻ tín dụng quận 7 ngày nay là một trong những nhu cầu thiết yếu của hầu hết người dân tại tp hcm.…
Xem thêm » -
Blogs

Con Ngài Bay Vào Nhà Có Ý Nghĩa Gì? Điềm Xấu Hay Tốt
bỗng nhiên có một cậu bé bay vào nhà bạn, điều này cũng khiến mọi người rất tò mò về hình dáng của nó, không…
Xem thêm » -
Hỏi đáp

Trung Cấp Luật Vị Thanh
lý thuyết toán lớp 5: đề-xi-mét vuông. mẫu vuông. HA bao gồm các dạng toán có lời giải chi tiết và bài tập tự luận…
Xem thêm » -
Blogs

Uống nước ép bưởi đúng cách để 1 tuần giảm liền 3-5kg
Cách giảm cân bằng bưởi là phương pháp giảm cân lâu đời và được coi là cách giảm cân an toàn, hiệu quả nhất mà…
Xem thêm » -
Blogs
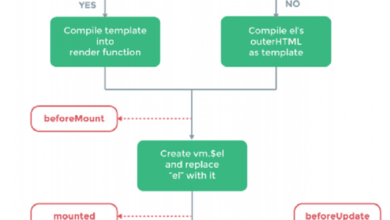
Tìm hiểu về component và vòng đời của Vue.js – Vue.js Lifecycle Hooks
y lấy mã của chúng tôi theo hướng mô-đun hóa, có nghĩa là tất cả các mã liên quan đến một đối tượng nhất định…
Xem thêm » -
Blogs
BufferOverflow – Tràn bộ nhớ đệm buffer overflow 1 stack overflow 1
lỗi tràn bộ đệm, chắc hẳn ai cũng gặp lỗi này khi lập trình. Tràn bộ đệm xảy ra khi dữ liệu được lưu trữ…
Xem thêm » -
Blogs

Từ trong tiếng Việt (phần đầu)
• đơn vị cấu tạo • phương thức cấu tạo: từ đơn tiết và từ ghép • phương thức cấu tạo: từ ghép và từ…
Xem thêm » -
Blogs

Đoàn Di Băng là ai? Chi tiết tiểu sử và độ giàu có của nữ ca sĩ 9x
đối với các bạn trẻ thế hệ 8x, 9x còn có thể gặp gỡ các ca sĩ của ban nhạc di. Hiện nay, có rất…
Xem thêm » -
Hỏi đáp

Bật mí thực hư các sản phẩm kích thích tình dục nữ
Trên thực tế, sản phẩm thuốc kích dục nữ có xấu và tiêu cực như nhiều người vẫn nghĩ không và nó có ảnh hưởng…
Xem thêm » -
Blogs

Beach Buggy Racing 2 trên Windows Pc
Tải xuống beach buggy racing 2 cho máy tính xách tay windows 11/10/8/7: Hiện tại, hầu hết các ứng dụng chỉ được phát triển cho…
Xem thêm » -
Blogs

Ghim ngay 9 quan buffet quan 7 sieu chat luong voi gia hat de
chỉ với vài phút duyệt mạng xã hội, bạn có hàng chục nhà hàng, quán sushi ở quận 7 , từ sang trọng đến bình…
Xem thêm » -
Blogs
Cot song that lung tieng anh la gi
Từ vựng thể hiện một trong những kỹ năng quan trọng nhất cần thiết để dạy và học ngoại ngữ. nó là nền tảng để…
Xem thêm » -
Blogs

Vòng tay phong thủy đá mắt hổ tâm vàng
Trái tim của vòng tay phong thủy đá mắt hổ vàng được làm từ loại đá quý: mắt hổ, với những đường vân vàng huyền…
Xem thêm » -
Blogs

Nam mo thay toc rung la diem gi
i – nằm mơ thấy tóc rụng có ý nghĩa gì? Rụng tóc là tình trạng có thể xảy ra với bất kỳ ai, tuy…
Xem thêm » -
Blogs

Cà phê nguyên chất giá sỉ chất lượng cao ở Phú Yên
Bạn đang tiếp thị mô hình cà phê nguyên chất, cà phê rang xay ở Phú Yên, nhưng “bạn đã mất quá nhiều khách hàng.…
Xem thêm » -
Blogs

Phần cứng máy tính là gì? Chi tiết các bộ phận trong phần cứng
Bạn sử dụng máy tính đã lâu nhưng bạn đã hiểu rõ phần cứng máy tính là gì và chi tiết các thành phần của…
Xem thêm » -
Blogs

Làm thẻ tín dụng bao lâu thì lấy được và mất bao nhiêu tiền?
ngày càng nhiều khách hàng mong muốn có thẻ tín dụng với mục đích thuận tiện trong việc mua sắm và hưởng nhiều ưu đãi.…
Xem thêm » -
Blogs
![Cấu trúc It was not until: Cách dùng chi tiết [kèm ví dụ, bài tập]](https://vccidata.com.vn/wp-content/uploads/it-was-not-until-nghia-la-gi-390x220.jpeg)
Cấu trúc It was not until: Cách dùng chi tiết [kèm ví dụ, bài tập]
Mọi người sử dụng “it before” để nhấn mạnh thời điểm có điều gì đó xảy ra. đây là một cấu trúc mà chúng ta…
Xem thêm » -
Blogs

Cac so trong phep tru goi la gi
bài tập toán 2, bài: số bị trừ – số bị trừ – hiệu . xin chào các em học sinh lớp 2. họ đã…
Xem thêm » -
Blogs

Ficbook
giới thiệu về nội dung i. fanfic là gì? ii. Fan hư cấu có vi phạm bản quyền hay không? iii. Fanfic có vi phạm…
Xem thêm »
